PD-1/PD-L1抑制剂治疗肺癌的前景与挑战
PD-1/PD-L1抑制剂治疗肺癌的前景与挑战
(神秘的地球uux.cn报道)据EurekAlert!:近日,上海交通大学附属胸科医院陆舜教授团队在SCIENCE CHINA Life Sciences (《中国科学:生命科学》英文版) 发表题为“Effectiveness of PD-1/PD-L1 inhibitors in the treatment of lung cancer: Brightness and challenge”的综述文章。该文深入介绍了PD-1/PD-L1抑制剂治疗非小细胞肺癌及小细胞肺癌的现状、单药以及联合用药的治疗现状、各种生物标志物的最新进展及其对免疫抑制剂的耐药性的研究,以及正在进行的中国患者的临床试验。
肺癌是全球主要的死亡原因之一,根据世卫组织的数据,2018年约有209万肺癌新发病例,同时肺癌也是中国癌症相关死亡的主要原因[1]。
在过去的十年中,免疫治疗被认为是肺癌治疗中最重要的突破之一。免疫肿瘤学(I-O, Immuno-Oncology)可分为三类:(1)主动免疫:疫苗、细胞因子和检查点抑制剂;(2)被动免疫:靶向单克隆抗体等;(3)混合免疫:主动和被动相结合的方法。其中,免疫检查点,特别是PD-1/PD-L1轴被认为是最有希望的靶点。PD-1/PD-L1轴抑制剂对肺癌患者的预后有重要影响,从而成为肺癌二线治疗的首选。各种临床研究进一步探究了PD-1/PD-L1轴抑制剂与化疗的联合使用,促使其成为部分肺癌的一线治疗首选,并迅速改变了肺癌的治疗模式。
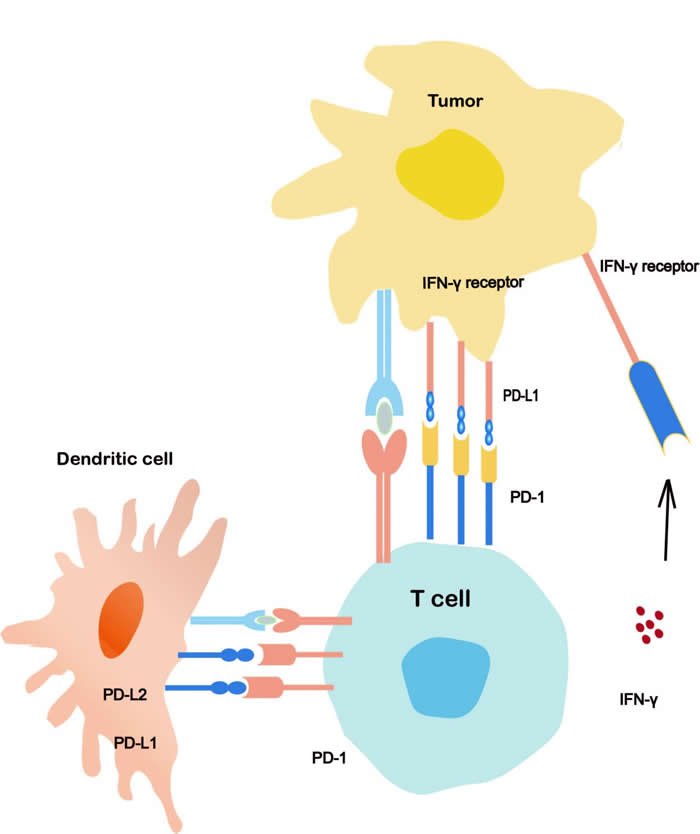
PD-1是CD28家族的一员,在多种免疫细胞中表达,特别是外周组织中活化的CD8+T细胞、CD4+T细胞和B细胞中[2]。PD-1有两个结合配体,PD-L1(B7-H1或CD274)和PDL2(B7-DC或CD273)。PD-L1表达于活化的T细胞、B细胞、巨噬细胞、树突状细胞和癌细胞,PD-L2的表达有限,主要表达于活化的巨噬细胞、树突状细胞和少量肿瘤细胞。PD-1/PD-L1结合抑制了细胞毒性T淋巴细胞的增殖和存活,诱导浸润性T细胞凋亡,且减少细胞因子的产生[3,4]。PD-L1在27%到57%的NSCLC患者中表达[5],PD-1/PD-L1通路在肿瘤细胞的免疫逃逸中起重要作用[6,7]。肿瘤细胞通过上调PD-L1来抑制T细胞的活动,从而逃避免疫反应。PD-1或PD-L1抑制剂通过阻断抑制的T细胞信号,重新激活CD8+T细胞的抗肿瘤活性[8]。基于这一背景,许多针对PD-1途径的药物正在开发中,并进行了临床试验。目前美国FDA已批准Nivolumab、Pembrolizumab(PD-1抑制剂)、Atezolizumab、Avelumab和Durvalumab(PD-L1抑制剂)应用于肿瘤的临床治疗。然而,哪些患者受益最多、如何识别存在原始或获得性耐药风险的患者,还没有完全确定。
肿瘤微环境错综复杂,各种免疫过程相互影响,使肺癌的免疫疗法在临床转化中面临诸多问题。例如,只有20%-25%的非小细胞肺癌患者对免疫抑制剂表现出可持续的反应[9],而影响免疫抑制剂临床疗效的因素也是多方面的,确定可靠免疫抑制剂的临床或生物标志物是其中的重要一环。PD-L1是FDA批准的第一个免疫检查点抑制剂的生物标志物,然而在肿瘤不表达PD-L1的患者中可以发现PD-1/PD-L1抑制剂的临床益处;反之,许多肿瘤高度表达PD-L1的患者不能受益于PD-1/PD-L1抑制剂。更多更有效的生物标志物需要被探究,以便筛选出最适合免疫治疗的目标人群。该文也对此作了总结和分析,包括肺癌患者中肿瘤突变负荷(TMB)、特异性基因突变,甚至肠道微生物群等对于免疫检查点抑制剂反应的关联。
参考文献
[1] W. Chen, R. Zheng, H. Zeng, S. Zhang, Epidemiology of lung cancer in China, Thoracic cancer, 6 (2015) 209-215.
[2] Y. Agata, A. Kawasaki, H. Nishimura, Y. Ishida, T. Tsubata, H. Yagita, T. Honjo, Expression of the PD-1 antigen on the surface of stimulated mouse T and B lymphocytes, Int Immunol, 8 (1996) 765-772.
[3] K. Karwacz, C. Bricogne, D. MacDonald, F. Arce, C.L. Bennett, M. Collins, D. Escors, PD-L1 co-stimulation contributes to ligand-induced T cell receptor down-modulation on CD8+ T cells, EMBO Mol Med, 3 (2011) 581-592.
[4] D.M. Pardoll, The blockade of immune checkpoints in cancer immunotherapy, Nat Rev Cancer, 12 (2012) 252-264.
[5] Y.B. Chen, C.Y. Mu, J.A. Huang, Clinical significance of programmed death-1 ligand-1 expression in patients with non-small cell lung cancer: a 5-year-follow-up study, Tumori, 98 (2012) 751-755.
[6] Y. Iwai, M. Ishida, Y. Tanaka, T. Okazaki, T. Honjo, N. Minato, Involvement of PD-L1 on tumor cells in the escape from host immune system and tumor immunotherapy by PD-L1 blockade, Proc Natl Acad Sci U S A, 99 (2002) 12293-12297.
[7] J.M. Taube, R.A. Anders, G.D. Young, H. Xu, R. Sharma, T.L. McMiller, S. Chen, A.P. Klein, D.M. Pardoll, S.L. Topalian, L. Chen, Colocalization of inflammatory response with B7-h1 expression in human melanocytic lesions supports an adaptive resistance mechanism of immune escape, Sci Transl Med, 4 (2012) 127ra37.
[8] E.B. Garon, N.A. Rizvi, R. Hui, N. Leighl, A.S. Balmanoukian, J.P. Eder, A. Patnaik, C. Aggarwal, M. Gubens, L. Horn, E. Carcereny, M.J. Ahn, E. Felip, J.S. Lee, M.D. Hellmann, O. Hamid, J.W. Goldman, J.C. Soria, M. Dolled-Filhart, R.Z. Rutledge, J. Zhang, J.K. Lunceford, R. Rangwala, G.M. Lubiniecki, C. Roach, K. Emancipator, L. Gandhi, K.-. Investigators, Pembrolizumab for the treatment of non-small-cell lung cancer, N Engl J Med, 372 (2015) 2018-2028.
[9] C. Kaderbhaï, Z. Tharin, F. Ghiringhelli, The Role of Molecular Profiling to Predict the Response to Immune Checkpoint Inhibitors in Lung Cancer, Cancers, 11 (2019).
全文链接 http://engine.scichina.com/doi/10.1007/s11427-019-1622-5