《自然医学》:中国学者贺建奎的“基因编辑宝宝”可能有早逝风险
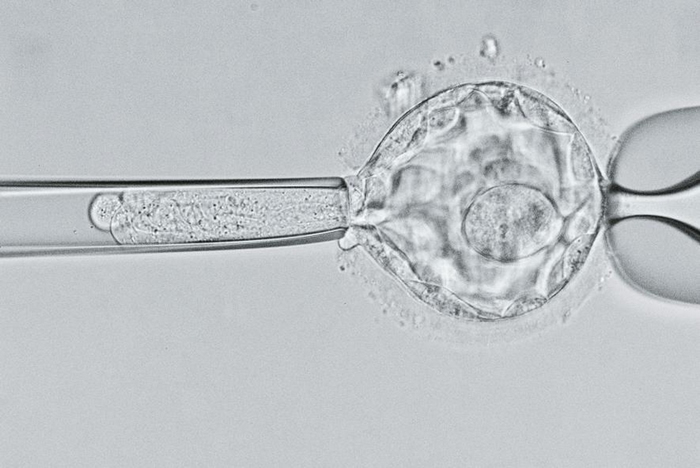
在这幅显微影像中,科学家仔细审视一个五天大的胚囊(blastocyst),寻找囊状纤维化(cystic fibrosis)的基因。 研究人员会运用各种技巧处理疾病的遗传根源,包括基因编辑在内。但正如最近的研究成果显示,对人类基因体进行可遗传的改变,可能会带来无法预期的风险。PHOTOGRAPH BY DAVID LIITTSHWAGER, NAT GEO IMAGE COLLECTION
(神秘的地球uux.cn报道)据美国国家地理(撰文:MICHAEL GRESHKO 编译:MICHAEL GRESHKO 摄影:钟慧元):2018年,一位中国学者宣布有两位经过基因编辑的宝宝诞生了,震撼了全世界。 这些突变造成的可能是伤害,而不是好处。
中国学者贺建奎在2018年11月宣布有两个经过他编辑基因的宝宝出生,震撼了全球医学界。 这也是经过Crispr-Cas9技术进行可遗传基因修改的第一批人类婴儿。 贺建奎说,他进行这项修改是为了降低宝宝得到HIV的风险,但这个新闻立刻激起大众对这种作法在道德与医学方面、以及将基因编辑用于人类身上的质疑。
如今,有一项研究发现,这项编辑工作其实可能会伤害宝宝的寿命。
正如6月3日发表在《自然医学》(Nature Medicine)期刊上的一篇研究指出,研究人员分析了一个英国的基因数据库之后,发现DNA天生就像贺建奎修改过的宝宝DNA的人,在76岁之前过世的机率比没有这种特征的人高约21 %。
「大众可能会有一种想法,以为当你只有一个突变的时候,只会产生一种影响。 但事实上,一个突变可能会产生多种不同影响,」这项研究的共同作者、加州大学柏克莱分校(University of California, Berkeley)的生物学家拉斯密斯. 尼尔森(Rasmus Nielsen)说。
「当我们想把基因工程运用在人体上的时候,需要考虑的事情非常多,其中之一就是后果真的非常难以预测──也就是说,一个突变在某种情况下是有益的,但在其他状况下却会是有害的。 」他说。
风险提高
贺建奎在2018年的公开演说中表示,他是为了抵抗HIV,也就是人类免疫不全症病毒(human immunodeficiency virus)。 他的做法是编辑CCR5基因,使之产生突变,而这个基因会负责免疫细胞外面一个受器的编码,也因此是免疫系统表现的重要控制因素。 CCR5基因的各种变异中,有最多人研究的是∆32变异,这种变异会使CCR5基因变得比较短,而且基本上是坏掉的。 这样的损害可以保护基因不受HIV感染,因为病毒感染免疫细胞,靠的是与功能完善的CCR5基因所编码的蛋白质结合。
但HIV的治疗其实已经发展了很久,许多专家当时就指出这种作法在医疗上是没有必要的。 更重要的是,当CCR5基因坏掉时,其他病原体便有机会蓬勃发展,制造出别的危险因子。 举例来说,2015年有一项研究显示,如果有一个或两个CCR5-∆32变异的话,会让人死于流感的机率提高将近四倍。
而霍建奎造成的突变虽然并不是和∆32变异一模一样,但宝宝的CCR5基因断裂的方式看起来却很像。 为深入了解这对宝宝来说可能代表什么意义,尼尔森和柏克莱大学的博士后研究员魏馨竹爬梳了英国人体数据库(UK Biobank, 一个搜集自愿者DNA的数据库),去了解那些天生有两个CCR5-∆32变异的人的命运。
为了抵销取样上的偏差,魏馨竹和尼尔森彼此对照比较了1000个随机产生的数据子集。 比较之后,他们发现整体上来说,若有两个CCR5-∆32变异,会让一个人在76岁之前死亡的机率提高了3%~46%,风险平均提高了21%。
魏馨竹和尼尔森指出,他们的分析结果不应过度解读,部分原因是因为现今的DNA数据库都有地理上的偏差。 他们的研究根据的是英国志愿人士的基因体,而不是中国人的。 类似的偏差也使得贺建奎在过去、还有编辑宝宝DNA的研究正当性在一开始就有问题:之前研究所发现的CCR5-∆32可抵抗HIV的现象,是出现在欧洲族群身上、而不是东亚族群身上。
「我希望能明确指出的,是突变造成的影响取决于遗传的背景与环境,我们也没有信息可以猜测这个变异对东亚裔人口会有什么影响,」这篇研究的主要作者魏馨竹在一封电邮中指出。
持续的影响
这项新发现势必会让大众的注意力重新聚焦在贺建奎的研究所引起的道德问题上。 在贺建奎宣布之前和之后,全世界的学者都在呼吁要暂时停止对人类基因体进行可遗传的编辑。 5月份一篇发表在《自然》(Nature)期刊上的论文中,一群重要的中国生物伦理学家谴责贺建奎,并呼吁应彻底修改中国在研究伦理方面的管理准则。 1月时,贺建奎遭中国深圳的南方科技大学解职。
研究人员同时也谨慎指出,贺建奎的作法虽有争议,但不应该就此让CRISPR革命性的医疗潜力打了折扣,因为这项基因编辑技术可以应用在许多治疗上,又不会产生可遗传的改变。 比方说,若要治疗基因疾病,科学家可以从一个人的器官中采集细胞,用CRISPR技术修复这些细胞的基因之后,再把已修复的细胞放回该器官中、让细胞重新长好长满。 同样的,研究人员也可利用CCR5-∆32来协助治疗HIV,方式是修正已经有HIV的人的免疫细胞,让他们对病毒更有抵抗力。
然而,贺建奎编辑这对双胞胎女孩的基因体时,她们还是受精卵──也就是说,他所做的改动会出现在她们体内几乎所有细胞中,包括她们的卵子。 如果这对小名为露露和娜娜的双胞胎未来决定要用自己未再经过进一步修改的卵子来生育下一代,那她们的后代就确定至少会有一个坏掉的CCR5基因。
「差别就跟改动整个计算机操作系统一样大,跟只修改为特定用途而安装的一个[独立]软件刚好相反。 」魏馨竹在电邮中说。 「大部分的时候,我认为,如果你的计算机出问题,要是能用其他的方法解决,你是不会为了解决问题而更新整个操作系统的。 」
同时,CRISPR也不是百分之百精准,所以宝宝身上的其他基因也可能会遭到改动,未来或许会出现未知、或不想要的后果。 可能还需要几十年,才会知道露露和娜娜碰会碰到什么状况。 在《自然》期刊中,中国生物伦理学家群也提出,一定要制定程序,终身监测并照顾这一对双胞胎。
但即使在此刻,这对双胞胎也是对全球的沉重提醒,正如CRISPR的共同发现者、加州大学柏克莱分校的遗传学家珍妮弗. 杜德纳(Jennifer Doudna)在4月号的《时代》(TIME)杂志文章中所提到的。
「在科学社群努力建立更强固防卫措施的同时,」杜德纳写道,「贺建奎却忽视基本的医学誓言『不加害』,做出了攸关命运的决定,冒着出现非期望后果的风险,他很可能会因为人类历史上对科学工具最可怕的滥用事件之一,而使得自己臭名传千古。 」