英国牛津大学和生物制药公司阿斯特捷利康合作研发的COVID-19疫苗进入测试最后阶段
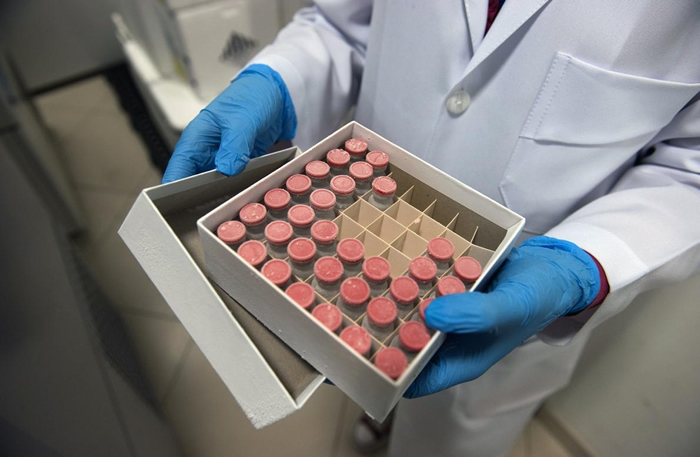
在巴西里约热内卢的多尔研究与教育学院,装着牛津大学候选疫苗ChAdOx1样本的盒子。 PHOTOGRAPH BY MAURICIO SUSIN, NATIONAL GEOGRAPHIC BRASIL
(神秘的地球uux.cn报道)据美国国家地理(撰文:KEVIN DAMASIO 编译:钟慧元):「这是我身为国民的责任。 」一位志愿者在第三阶段测试于巴西展开时,谈到了这项紧凑的体验。
巴西,里约热内卢(Rio de Janeiro)──安德莉亚. 巴柏沙(Andréa Barbosa)因为手臂准备挨针而激动不已。 这位46岁的眼科医师,是COVID-19候选疫苗ChAdOx1在巴西进行临床试验的5000位自愿受试者之一。 这支疫苗是由英国的牛津大学和生物制药公司阿斯特捷利康(AstraZeneca)合作研发。
5月时,世界卫生组织首席科学家苏米嫣. 斯瓦米纳屈(Soumya Swaminathan)称ChAdOx1是进展最快的候选疫苗。
第一阶段和两项临床实验于4月份在南英格兰同时进行,检查了超过1000位年龄介于18-55岁之间的健康志愿者的安全与免疫反应。 这支疫苗目前已经进入研发的第三阶段,也是最后阶段:在巴西圣保罗联邦大学的特殊免疫生物学参考中心(Reference Center for Special Immunobiologicals)进行志愿者测试,另外也在由多尔研究与教育学院(D'Or Institute for Research and Education)经营的两个地方进行。
这支候选疫苗希望能快马加鞭取得英国药物及保健产品管理局(Medicines and Healthcare products Regulatory Agency, 简称MHRA)的许可,也因此使得巴西成为重要的测试场。 ChAdOx1临床研究最终也会在英国、美国和南非进行临床研究,目标是招募高达5万名志愿受试者。 并在整个11月期间收集来自所有测试的初步结果,若能证实疫苗有效,牛津团队就会在年底提出,以便向MHRA初步注册。
在美国,生物科技公司莫德纳(Moderna)的另一支候选疫苗,也在上周开始了第三阶段的临床测试。 该测试从全国89个地点招募了3万名志愿者测试这种传讯RNA(mRNA)疫苗的效果,这也将是美国国家卫生研究院许可的第一支这类疫苗。
参与测试疫苗,是一种缜密且耗时的过程。 志愿者必须经过仔细筛选,接受长达数个月的监测,还要面对可能出现有害副作用的风险。 但是,巴柏沙说,这些努力毫无疑问都是值得的。 「这是我身为国民的责任,是因为人道主义。 没有疫苗,我们就不知道这个状况什么时候才会结束。 」
巴柏沙从2007年就开始担任圣路易斯医院集团(Rede D'Or São Luiz)的眼科部门负责人,这是巴西的一个全国性医疗集团。 从3月底到6月,造访她诊所的病人从每天100人降到十几人──大部分都是像青光眼和糖尿病视网膜病变之类需要长期治疗的严重病患。
在COVID-19公卫危机不断扩张的同时,巴柏沙也希望能加入这场对抗病毒的战役,所以她征求了圣路易斯医院集团董事会的许可,希望能和其他医疗专业人员一起在前线工作。 她的要求被否决了——他们告诉她,她在急诊单位工作的时间还不够长。 「不能治疗新冠肺炎病患让我觉得非常挫折。 」巴柏沙说。
所以当巴西国家卫生管理局(Brazilian Health Regulatory Agency)核准了ChAdOx1的临床测试时,她立刻抓住这个参与的机会。 「现在我终于能以某种方式参加了,」她说。
候选疫苗的诞生
当目前这场疫情爆发时,牛津大学已经在运用所谓的病毒载体技术开发另一种冠状病毒疾病MERS的疫苗。 自从MERS在2012年9月出现在沙特阿拉伯以来,迄今已经在27个国家现踪,有2494名病例、并造成858人死亡。
在2019年12月首度有人报告SARS-CoV-2、也就是新型冠状病毒时,这项研究已经进展到相当进步的阶段,所以这些科学家便运用他们的MERS技术与知识作为开发新疫苗的起点。 他们将SARS-CoV-2的棘蛋白(也就是协助COVID-19病毒入侵细胞的病毒表面突起物)插入引起普通感冒的腺病毒。 经过基因调整削弱且无法在人体细胞内复制的腺病毒,其功能就是所谓的病毒载体。
病毒载体疫苗的运作方式「就像是特洛伊木马。 」这项研究的巴西地区协调人苏. 安. 寇斯塔. 克莱门斯(Sue Ann Costa Clemens)医师说:「这个腺病毒里面藏着SARS-CoV-2的一部分,也就是棘蛋白。 在注入人体的时候,这个棘蛋白就会触发人体的免疫反应。 」
前面两阶段临床试验的初步结果,已于今年7月20日发表在《刺胳针》(The Lancet上。 参与者出现了轻微的副作用,像是疲倦和头痛,没有人出现严重的不良反应。 研究人员也识别出牛津疫苗触发了负责侦测与攻击病原体的两种主要防御系统的强烈免疫反应——也就是抗体与T细胞。
为何选择巴西?
克莱门斯是巴西雀屏中选进行ChAdOx1第三阶段测试的主因。 这位来自里约热内卢、52岁的医生在意大利生活了约20年。 她是西埃纳大学(University of Siena)的小儿传染病学教授,在该校创设了第一个全球性疫苗学课程,同时也是该校全球卫生研究所协调人,也是疫苗学硕士课程主任,还是比尔与梅琳达盖兹基金会(Bill and Melinda Gates Foundation)科学委员会的主席。
5月5日,牛津冠状病毒疫苗小组协调人、也在西埃纳大学教授病毒学部分课程的安德鲁. 波拉德(Andrew Pollard),邀请克莱门斯参与ChAdOx1临床测试。 她立刻就接受了。 在克莱门斯的职业生涯中,她曾领导过需要招募海量受试者的类似临床试验。 她曾在2005年参与拉丁美洲一项轮状病毒疫苗研究,研究内容包括要在六个月内找到6万名志愿受试者。
这一次,克莱门斯最初的目标是要挑选执行临床测试的研究中心。 她在寻找拥有优秀医疗专业人员、还有大量群众会接触到COVID-19的环境。 圣保罗联邦大学(Federal University of São Paulo),也就是她取得博士学位、目前也在那里进行研究工作的地方,正符合这些要求,他们也同意参与。
「第三阶段测试的目标,就是要证明疫苗能提供对抗这种疾病的保护。 」克莱门斯说:「我们要如何迅速作业、加以证明,并在短期内提供疫苗给大众? 」
在巴西的测试从6月28日分别于三个中心展开,由克莱门斯负责协调。 总共有5000名志愿者,分成两组接受疫苗施打。 其中一组施打的是候选疫苗ChAdOx1,另一组施打的是控制组疫苗。 这是一项随机双盲测试,也就是说志愿受试者是随机指定分组,受试者和研究人员都不知道哪个人打了哪一种疫苗,要直到测试结束才会知道。
研究人员选择四价脑膜炎ACWY疫苗当做控制组。 剂量跟ChAdOx1的剂量差不多,也就是说受试者获得的疫苗材料量差不多。 此外,研究人员已经知道其副作用,包括注射处会泛红或疼痛,以及轻微的、类似流感的症状。 研究团队决定不使用安慰剂疫苗──没有任何活性效果的物质──这样一来,志愿受试者还可以从这项研究得到一些好处。 (这种脑膜炎疫苗在巴西本来并没有广泛施打,克莱门斯说,因为比较贵。 )
成为人体受试者
眼科医生安德莉亚. 巴柏沙正符合参与疫苗测试的基本要求:身为健康的专业医疗人员,在日常生活中接触到冠状病毒的机会很高,而且年龄正好介于18到55岁之间。
她在7月4日第一次前往波塔福哥(Botafogo)的圣路易斯集团旗下诊所。 护理团队测量了她的生命体征、身高和体重。 然后她接受访谈,确保她符合所有的测试条件。 患有可控制疾病如气喘的人,是可以接受的,但有慢性病或免疫抑制方面问题的人则会被排除。
「我的案例有一点点复杂,因为我有接触性过敏,但他们查证过,我这一型的并不是排除条件。 」她说。 接触性过敏是在有特定物质接触到她的皮肤时,会引起轻微的过敏反应。
巴柏沙签署了知情同意书,确保她在接下来12个月内不会参与其他疫苗测试、也不会怀孕,且可以参加定期追踪。 那份15页的同意书解释了这项研究、疫苗,还有这次疫情的脉络,并描述了研究参与者面对的风险。 同时也指出,在能证实疫苗有效之前,受试者无法假定自己已受到保护、可抵抗COVID-19。 志愿者随时都可以退出这项研究。
她在谈话之后便返回护理区,进行鼻腔采样,以判定她是否感染了COVID-19。 她也验了孕,护士还采了血液样本进行血清测试,确定她是否有COVID-19的抗体,有抗体表示之前曾经感染过。 研究人员估计,有10%的志愿者有阳性反应,也使得他们丧失参与资格。
巴柏沙于7月9日返回诊所,工作人员告诉她,她所有检验结果都是阴性。 他们再次询问她的健康状况,然后她又再验了一次孕,再采了一次血液样本。 之后,她终于注射了疫苗。
她留下来接受观察约30分钟,以监测是否有任何立即的不良影响。 在离开之前,工作人员给了她一天份的止痛药,并且要求她每天都要填写线上问卷。
「他们问我有没有觉得恶心或发烧。 我用他们提供的温度计量了体温。 还必须记录下注射处观察到的所有症状与迹象,不管是发红、变硬或肿起来──他们还给了我一把尺来量。 」巴柏沙说。
巴柏沙下次回诊是8月1日。 在那之前,她还是一样在医院和诊所工作、过普通生活,但持续注意她应该在问卷上回报的任何可能症状或反应。 「我持续注意症状,不过我挺好的──并不觉得有什么异状。 打针的地方也没出现什么反应。 一点事也没有。 」
准备部署
如果测试参与者出现任何可能是COVID-19的症状,就必须返回诊所接受检测。 不良反应会被定期评估,研究人员也会检查受试者是否出现抗体。
注射疫苗之后约8到10天,人体就会开始出现免疫反应,但在这段期间内并不保证能有完整保护。 因此研究人员会在注射疫苗后28天再采一次血样,这段时间已长到足以让身体产生可辨识的防御细胞。
要「解盲」这项研究,需判断控制组或打了测试疫苗的人是否有确诊COVID-19。 这是测试疫苗是否有效的方式。 志愿受试者将接受为期一年的评估,但团队会利用在巴西进行的早期测试、还有在英国、美国与其他地方进行的扩大测试的资料,以便迅速因应事态发展。
「所有这些研究的部分结果会加以整合,应该会在11月时准备好,」克莱门斯说:「理想上是要整理成一份登记档案,在英国提交,如果能证明疫苗有效,就可以在今年取得许可。 」在那之后,就会立刻开始在英国和其他国家、包括巴西部署疫苗。
4月时,牛津大学和阿斯特捷利康宣布了一项协议,要制造10亿剂疫苗。 他们同意以成本价格销售疫苗,尽量让疫苗能广为取得。