新研究发现蛋白质MFSD1可以通过将癌细胞粘在周围的组织上而阻止它们迁移
新研究发现蛋白质MFSD1可以通过将癌细胞粘在周围的组织上而阻止它们迁移
(神秘的地球uux.cn报道)据cnBeta:手术切除或化疗可能被证明对消除最初的肿瘤有效,但往往癌细胞可以脱离并在身体周围产生二次生长。这被称为转移性癌症,实际上是该疾病的主要死因,其促使人们对阻止扩散的方法展开了大量的研究。
现在,一项新研究发现了一个新的目标--一种蛋白质,它可以通过将癌细胞粘在周围的组织上而阻止它们迁移。
虽然转移性癌症的危险是众所周知的,但不太清楚的是,为什么有些病人在治疗原发肿瘤后会出现转移性癌症,而有些则没有。挥之不去的癌细胞可以通过血液或淋巴管迁移到身体的其他部位进而形成新的肿瘤,这项新研究的作者正在试图通过一种名为MFSD1的蛋白质更多地了解并可能干预这一过程。
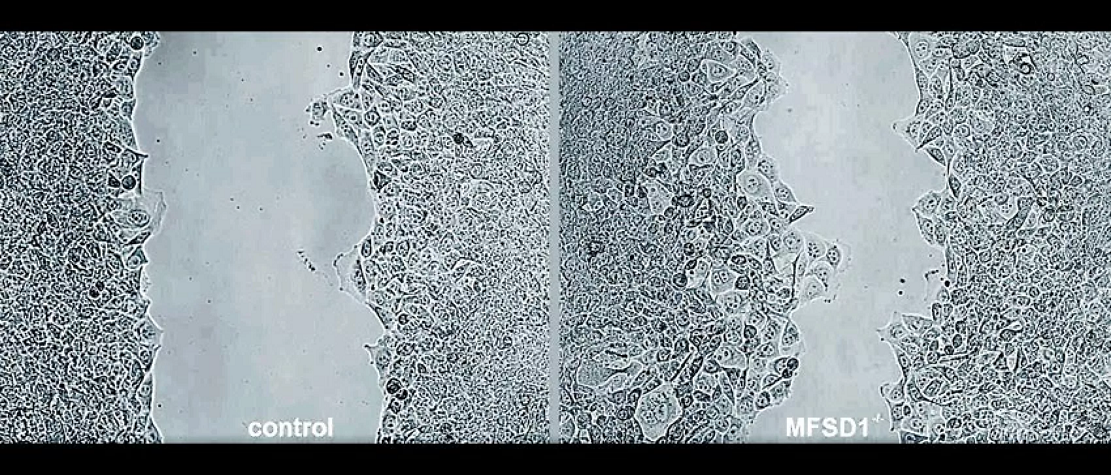
由奥地利科学技术研究所和苏黎世大学的科学家组成的研究小组此前通过对果蝇的实验发现,这种蛋白质在细胞迁移中发挥了作用,。果蝇是生物医学研究中最常用的模型之一,因为它们的生命周期很短,而且它们跟人类共享许多基因和生物功能。最新的研究集中在小鼠身上,科学家们设计了缺乏这种蛋白质的癌细胞。
这确实能使癌细胞比拥有该蛋白的癌细胞走得更快并表明MFSD1在细胞迁移中发挥着预防作用。研究团队在患有乳腺癌、结肠癌和皮肤癌的活体小鼠身上观察到了这种效果。
研究作者Daria Siekhaus指出:“在没有MFSD1的情况下,转移的情况强烈增加。”
为了研究其中的原因,科学家们对含有和不含有MFSD1蛋白的癌细胞进行了一种压力测试。这涉及到使用一个微小的橡胶工具将细胞从培养皿的表面刮走,那些含有MFSD1蛋白的细胞由于机械压力而迅速死亡。然而那些没有该蛋白的细胞基本上保持完整,这使得研究小组得出结论,缺乏MFSD1的细胞可以更容易地进入并通过血液。
这项研究的论文第一作者Marko Roblek说道:“我们想知道为什么较低的MFSD1水平除了允许它们更自由地移动之外还对肿瘤有利。比如当癌细胞在血液中旅行时,它们会经历大量的机械压力。”
通过观察,研究小组发现,MFSD1通过维持细胞表面被称为整合素的受体而产生这些影响,这使得整合素能让细胞相互粘连,同时还粘连到被称为细胞外基质的密集的周围网络。因此,缺乏MFSD1的肿瘤细胞不那么容易回收某些类型的整合素。
Siekhaus说道:“其结果是,细胞与周围组织和彼此之间的粘附性降低使得它们更容易迁移。”
虽然实验是在小鼠身上进行的,但该团队还通过检查癌症患者的数据探索了MFSD1在人类身上的作用。这显示了该蛋白的水平和受试者的预后之间的相关性。
Roblek说道:“我们已经看到,患有特定形式的乳腺癌、胃癌和肺癌的患者,如果MFSD1的水平较低,那么他们的预后会更差。高水平的MFSD1似乎是保护性的--它像肿瘤转移的抑制剂一样发挥作用。”
该团队的发现为针对MFSD1的新形式治疗奠定了基础,有可能提高其水平以抑制转移性癌症的扩散。有趣的是,科学家们还指出,如果他们能确定编码MFSD1蛋白的基因,那么它可以通过揭示癌症可能具有的侵略性来指导治疗。
Siekhaus说道:“如果这个标志物变得更加确定,医生可以用它来帮助分类癌症的侵略性并决定不同的治疗方案。”
相关报道:科学家开发新疗法 可通过让癌细胞“休眠”来防止肿瘤转移
(神秘的地球uux.cn报道)据cnBeta:根据一项新研究,一种新的治疗方法通过迫使癌细胞进入无法增殖的“休眠”状态,防止小鼠转移性肿瘤的生长。这项发表在《实验医学杂志》(JEM)上的研究可能会带来新的治疗方法,防止各种癌症类型的复发或扩散,包括乳腺癌和头颈鳞状细胞癌(HNSCC)。
许多癌症患者复发,往往是在最初治疗的几年或几十年后,并形成新的肿瘤,在同一部位重新生长或转移(扩散)到身体的其他部位。这些继发性肿瘤往往对治疗有抵抗力,是由个别肿瘤细胞产生的,这些肿瘤细胞在重新激活开始增殖之前可能会保持长时间的“休眠”状态。因此,如果研究人员能够找到一种使剩余的癌细胞处于“休眠”状态的方法,就可以防止病人复发。
在之前的一项研究中,西奈山伊坎医学院的Maria SOLEDad Sosa和阿尔伯特-爱因斯坦医学院的Julio A. Aguirre-Ghiso发现,癌细胞保持“休眠”的能力是由一种叫做NR2F1的蛋白质控制的。 这种受体蛋白可以进入细胞核并打开或关闭许多基因,激活一个防止癌细胞增殖的程序。原发性肿瘤中的NR2F1水平通常较低,但在休眠的扩散性癌细胞中却升高了。然后当癌细胞再次开始增殖并形成复发或转移性肿瘤时,NR2F1蛋白的水平再次下降。
Aguirre-Ghiso解释说:“因此,我们认为用一种小分子激活NR2F1可能是一种有吸引力的临床策略,可以诱导癌细胞休眠,防止复发和转移。”
在新的JEM研究中,Sosa和Aguirre-Ghiso的团队使用了一种基于计算机的筛选方法来确定一种名为C26的药物,它能激活NR2F1。 研究人员发现,用C26治疗患者衍生的HNSCC细胞能提高NR2F1的水平并阻止细胞增殖。
研究人员随后测试了C26是否会阻止小鼠的转移。注射了患者来源的HNSCC细胞的动物通常会形成大的原发肿瘤,在手术切除原发肿瘤后扩散到肺部。用C26治疗减少了原发肿瘤的大小,并且在手术后,进一步剂量的C26完全阻止了转移性肿瘤的生长。相反,啮齿动物的肺部只含有少数“休眠”的扩散性癌细胞,即使在停止治疗后也无法增殖。
Sosa和Aguirre-Ghiso的团队确定,通过激活NR2F1,C26迫使癌细胞进入一种长期的休眠状态,其特点是基因活动的独特模式。肿瘤显示出类似基因活动模式的癌症患者往往会更长时间不复发,这表明用C26型药物诱导这种休眠程序可能对人类有效。
Sosa说:“激活NR2F1的药物可能对乳腺癌特别有用。与ER阴性肿瘤相比,NR2F1在ER阳性肿瘤中高度富集,激活NR2F1可能能够抑制因抗雌激素疗法而保持在该状态的休眠癌细胞的苏醒。然而,由于C26治疗提升了NR2F1的水平,该方法也可能对其他受体蛋白水平本来就低的癌症有用。”
Aguirre-Ghiso说:“总的来说,我们的研究揭示了一种基于机制和合理设计的策略,利用NR2F1激活的休眠状态作为防止转移性复发的一种治疗选择。”